Warum David Goliath schlägt: Oxide verschleißen Diamant
Dr. Gianpietro Moras, Prof. Dr. Michael Moseler
Diamant ist der härteste Stoff auf unserem Planeten. Dennoch sind diamantbeschichtete Schneidwerkzeuge von Verschleiß betroffen, vor allem wenn sie Gesteine oder Ingenieurkeramiken schneiden, die reich an Oxiden wie Siliziumoxid oder Aluminiumoxid sind. Dieser Nachteil kann jedoch auch nutzbar gemacht werden: Wissenschaftler aus Cardiff haben kürzlich experimentell gezeigt, dass Oxide zum Diamantpolieren eingesetzt werden können, wobei Oberflächenrauigkeiten von 1 Nanometer erreicht werden (chemisch-mechanisches Polieren, CMP). Dieser Befund ist erstaunlich, wenn man bedenkt, dass Oxide sehr viel weicher als Diamant sind! Dank dieser Technik können Diamantschichten in mikroelektronischen Geräten eingesetzt werden.
Die Erhöhung der Lebensdauer von Diamantwerkzeugen und die Optimierung des CMP-Prozesses (zum Beispiel mittels Dotierstoffen beziehungsweise Additiven) sind darum von großem wirtschaftlichem Interesse. Um kostenintensive »Trial-and-Error«-Prozesse zu vermeiden, ist ein detailliertes Verständnis der mikroskopischen Verschleißmechanismen nötig. Bislang gibt es dazu jedoch nur wenige fundamentale Kenntnisse. Da der Diamantverschleiß nicht durch die Härte des Oxids erklärt werden kann, bleibt nur die Möglichkeit, dass es sich um einen tribochemischen Verschleißprozess handelt. In diesem Fall wären mechano-chemische Bindungsbrüche für den Verschleiß verantwortlich. Da während des CMP-Prozesses keine mikroskopischen Verschleißpartikel gefunden werden, lässt sich vermuten, dass einzelne Kohlenstoffatome nacheinander aus der Diamantoberfläche herausgebrochen werden.
Quantenmechanische Simulationen
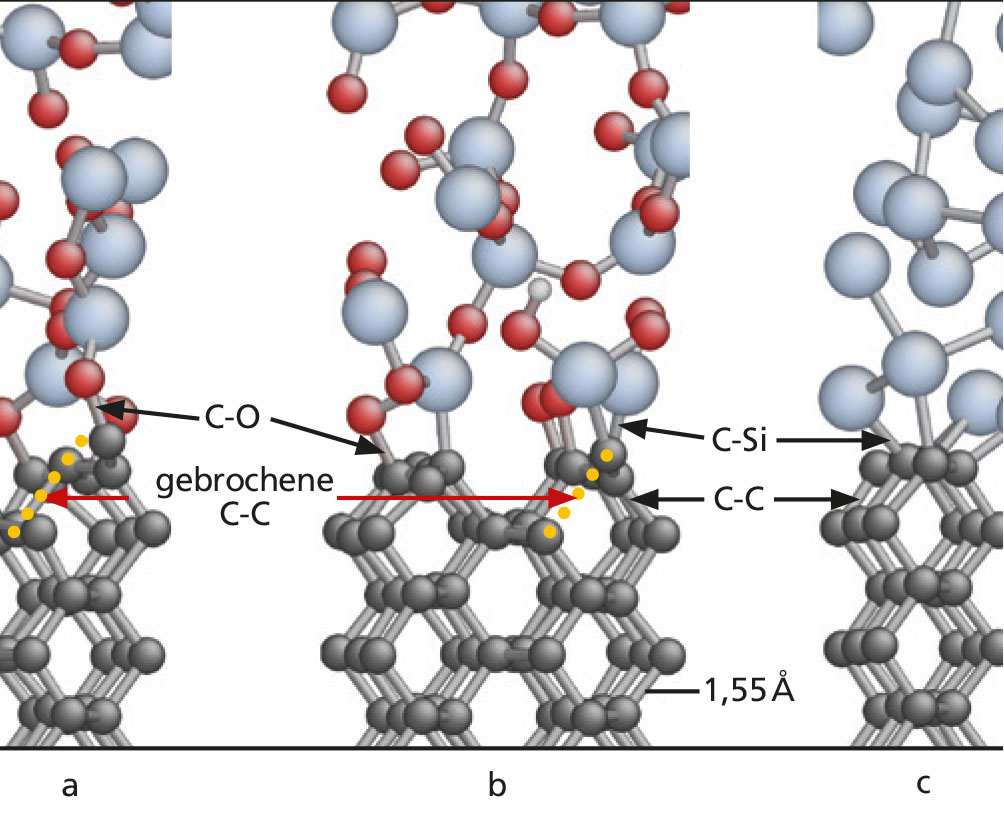
In einem Projekt mit einem Diamantwerkzeughersteller galt es diesen Prozess zu verstehen (A. Peguiron et al., Activation and mechanochemical breaking of C-C bonds initiate wear of diamond (110) surfaces in contact with silica, Carbon 98, 2016). Hierzu führten wir Molekulardynamiksimulationen durch, die die Bewegung der Atome an den Grenzflächen zwischen amorphem Siliziumoxid und der Diamant (110)-Oberfläche sichtbar machten (Abbildung 1a, b). Da tribologische Kontakte generell nicht direkt experimentell zugänglich sind, stellen Molekulardynamiksimulationen mit quantenmechanischen Kraftfeldern die effektivste Methode dar, um chemische Grenzflächen-Prozesse zu beobachten. Um zu verstehen, ob Verschleißprozesse nur aufgrund der besonderen chemischen Wechselwirkung zwischen Kohlenstoff und dem Sauerstoff des Oxids stattfinden, studierten wir zusätzlich das Verhalten von Diamant in Kontakt mit amorphem Silizium (Abbildung 1c). Amorphes Silizium ist mechanisch ähnlich zu Siliziumoxid, enthält jedoch keinen Sauerstoff.
Tight-Binding-Molekulardynamiksimulationen zeigten, dass es in der Tat möglich ist, einzelne Kohlenstoffatome aus der Diamantoberfläche herauszuziehen. Damit dies stattfinden kann, müssen starke kovalente Bindungen zwischen den obersten C-Atomen und der Diamantoberfläche aufbrechen. Der Bindungsbruch geschieht nur für spezielle C-C-Bindungen und nur, wenn Diamant mit Siliziumoxid in Kontakt ist (Abbildung 1a, b). Bei Silizium als Gegenkörper konnten wir keinen C-C-Bindungsbruch beobachten.
Starke und schwache Grenzflächenbindungen
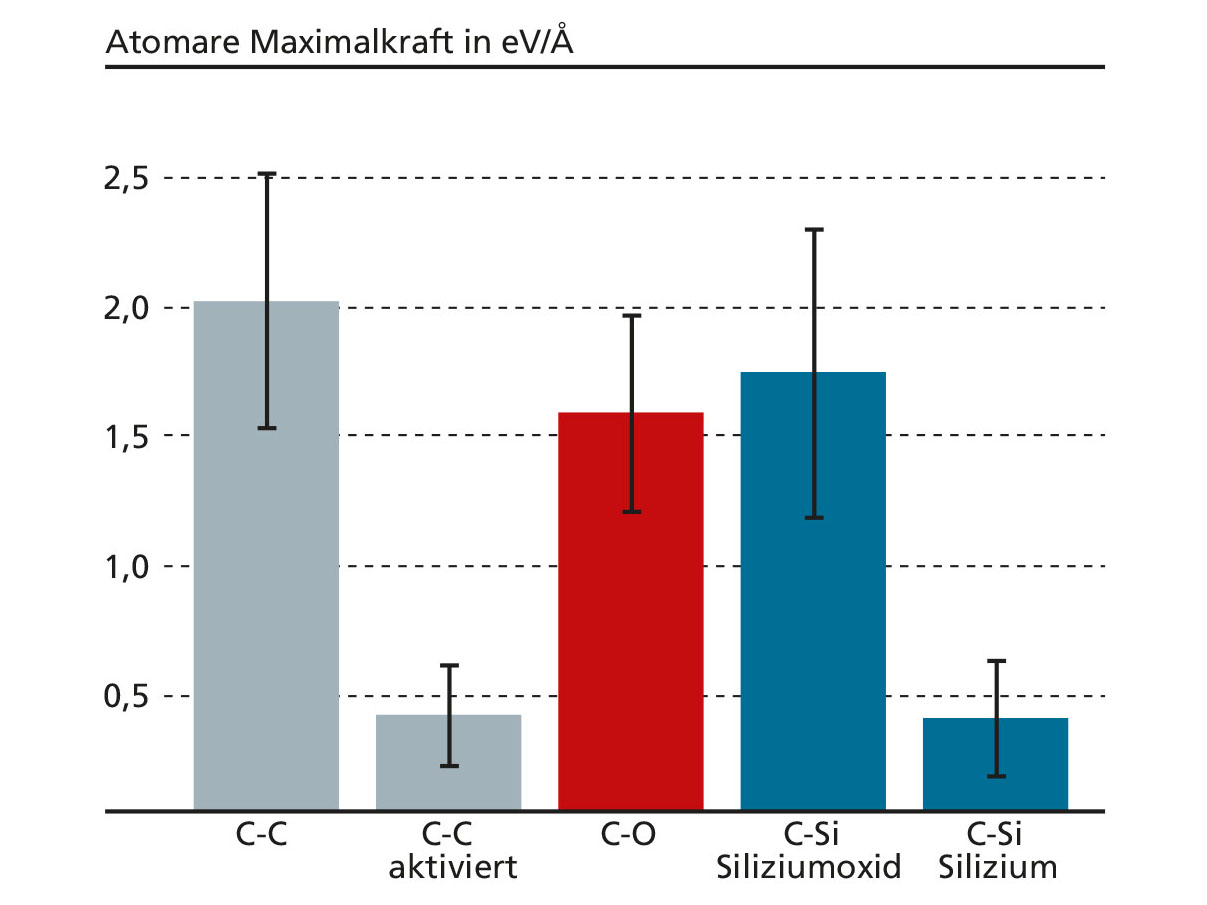
An der tribologisch belasteten Siliziumoxid-Diamant-Grenzfläche können C-C-Bindungen nur dann aufbrechen, wenn sie schwächer sind als die C-Si- oder C-O-Bindungen, die an den C-Oberflächenatomen ziehen. Mittels Dichtefunktionaltheorie konnten wir die Stärke der Bindungen berechnen und erzielten unvorhergesehene Ergebnisse. In erster Linie sind diamantähnliche C-C-Bindungen etwas stärker als C-O- und
C-Si-Bindungen. Gleichzeitig sind die C-Si-Bindungen an der Siliziumoxid-Diamant-Grenzfläche wesentlich stärker als an der Silizium-Diamant-Grenzfläche. Wir konnten zeigen, dass die Polarisierung von Siliziumoxid für die Stärke der C-Si-Bindungen verantwortlich ist. Zudem traten gelegentlich schwache C-C-Bindungen an der Siliziumoxid-Diamant Grenzfläche auf und versagten, wenn ein Si- oder ein O-Atom an ihnen zog (Abbildung 2). Derart schwache C-C-Bindungen konnten wir an der Silizium-Diamant-Grenzfläche nicht beobachten.
Aktivierung von chemischen Bindungen in Diamant
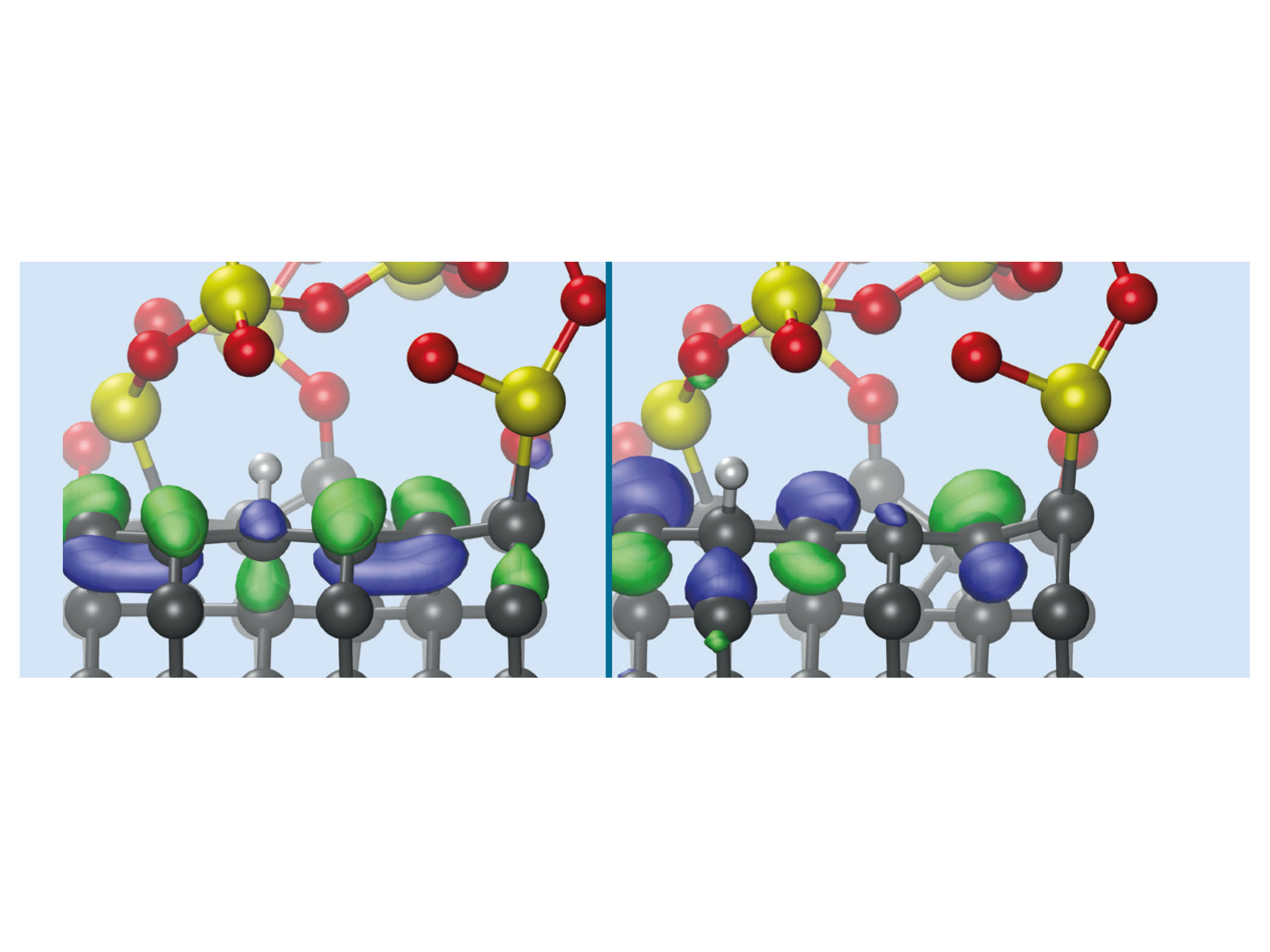
Mittels einer detaillierten Analyse der elektronischen Struktur der Grenzfläche konnten wir erklären, wie oberflächennahe C-C-Bindungen in Diamant von Siliziumoxid geschwächt werden können. Die Diamant-(110)-Oberfläche ist durch eine aromatische Struktur charakterisiert (ähnlich Graphit). In Kontakt mit Siliziumoxid bilden sich nur wenige C-O- und C-Si-Bindungen, die die aromatische chemische Struktur leicht stören und damit die Verlängerung einiger C-C-Bindungen verursachen. Diese verlängerten Bindungen sind chemisch aktiviert (das heißt schwächer als in Diamant) und können daher leicht aufbrechen (Abbildung 2). Ist die Diamantoberfläche in Kontakt mit Silizium, geschieht diese Aktivierung hingegen nicht. In letzterem Fall ist die Anzahl der Grenzflächenbindungen viel größer als an der Siliziumoxid-Diamant-Grenzfläche. Demzufolge verliert die Diamantoberfläche ihren aromatischen Charakter und wird diamantähnlich, das heißt alle C-C-Bindungen bleiben stark.
 MikroTribologie Centrum μTC
MikroTribologie Centrum μTC